表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)已然成为表皮生长因子受体(EGFR)突变晚期非小细胞肺癌(NSCLC)患者的标准治疗之选,其中第三代 EGFR-TKI 更是在临床上备受瞩目。依据表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)对 EGFR 不同突变类型的选择性抑制能力,可将 EGFR-TKI 划分为第一代、第二代和第三代。
近日发表于《Lung Cancer》的一篇综述 “Treatment sequences in EGFR mutant advanced NSCLC”,对 EGFR 突变晚期非小细胞肺癌的治疗序列及其最新进展进行了总结,旨在为患者及医疗专业人士提供全面的治疗参考。

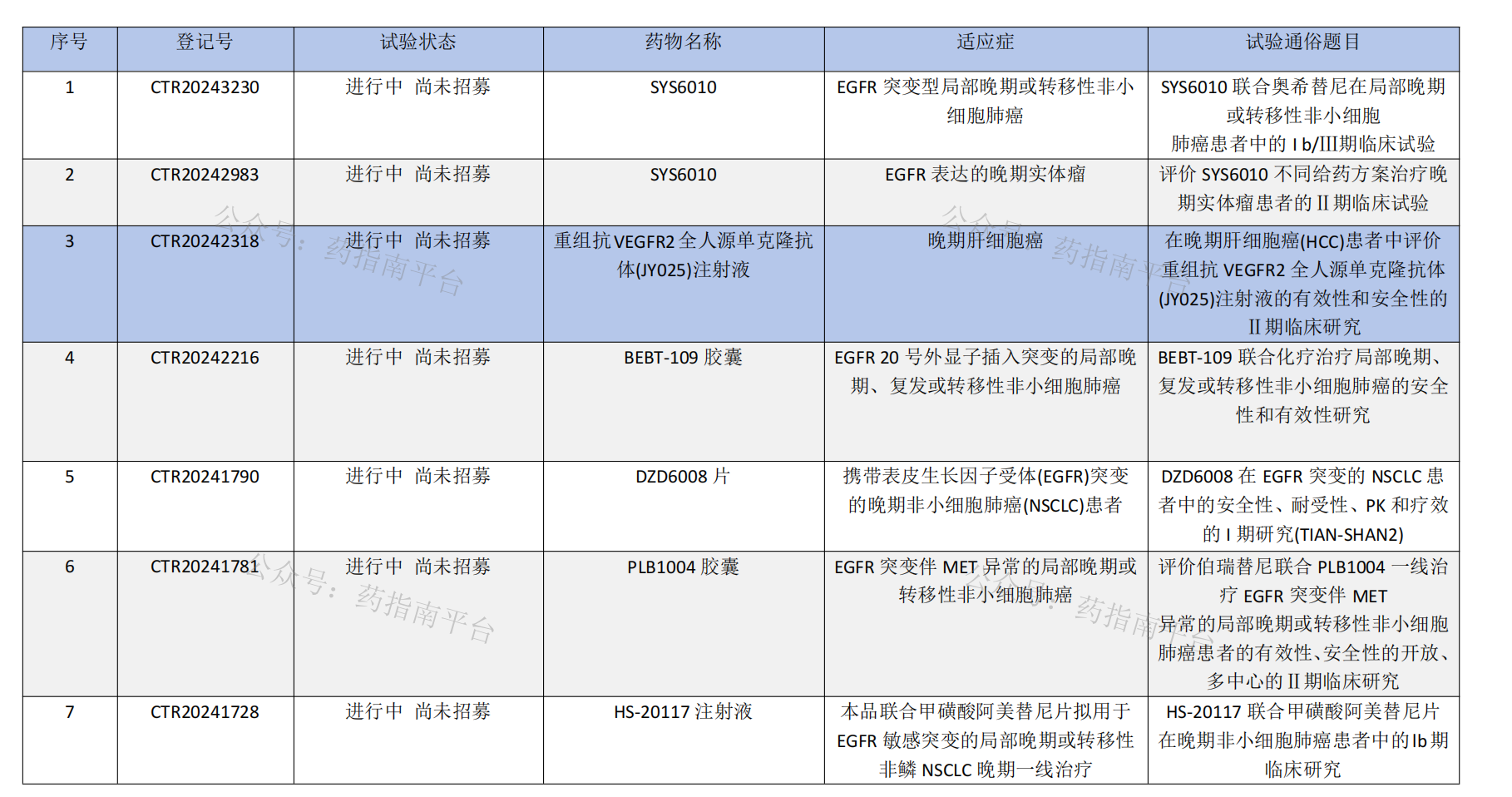
第一代EGFR-TKI:主要针对EGFR的敏感性突变进行抑制,例如外显子19的缺失和外显子21的L858R点突变。然而,这类药物对出现的获得性耐药突变,特别是外显子20的T790M突变,并不具备抑制效果。
第二代EGFR-TKI:除了能够抑制上述的敏感性突变,还能在一定程度上抑制某些获得性耐药突变。但值得注意的是,它们对外显子20的T790M突变依然无效。此外,第二代药物对野生型EGFR也表现出较强的靶向作用,这可能会增加不良反应的风险。
第三代EGFR-TKI:能够有效地抑制外显子20的T790M突变,并且对野生型EGFR的选择性较低。这种特性使得第三代药物在治疗效果和安全性方面都有所提升。
另外,三代EGFR-TKI在控制脑转移方面也展现出优势。它们能够更好地穿透血脑屏障,在脑部达到较高的浓度,从而有效地抑制脑部肿瘤的生长。
正因为这些特点,三代EGFR-TKI正逐渐成为EGFR突变NSCLC患者的首选治疗方案。
第一代:吉非替尼、厄洛替尼、埃克替尼;
第二代:阿法替尼、达可替尼;
第三代:奥希替尼、阿美替尼、伏美替尼、贝福替尼、瑞齐替尼
已获批上市的EGFR-TKI靶向药物及医保类别(价格仅供参考)
目前,存在多种策略能够提升三代 EGFR-TKI 在 EGFR 突变晚期非小细胞肺癌(NSCLC)一线治疗中的疗效,这些策略能够延缓三代 EGFR-TKI 耐药的出现,具体包括:采用更有效的一线治疗策略以推迟耐药发生;在达到最大治疗缓解时,通过局部治疗消除残留病灶或直接靶向耐药细胞;以及研发针对三代 EGFR-TKI 获得性耐药的新治疗策略。
1.提升 EGFR 突变晚期非小细胞肺癌(NSCLC)一线治疗的疗效
将 EGFR 酪氨酸激酶抑制剂(TKI)与化疗药物联合使用,或许有助于降低耐药性的出现概率,并减轻肿瘤负担以及耐药细胞的持久性。在 FLAURA2 国际 III 期研究中,奥希替尼与化疗联合治疗组的主要终点无进展生存期(PFS)明显优于奥希替尼单药治疗组。联合治疗组的中位 PFS 达 25.5 个月,而单药治疗组为 16.7 个月,风险比(HR)为 0.62(95% 置信区间,CI,0.49 - 0.79)。对于基线时有中枢神经系统(CNS)转移的患者(n = 226),联合治疗组的中位 PFS 为 24.9 个月,奥希替尼单药组为 13.8 个月,HR 为 0.47(95% CI,0.33 - 0.66),表明联合治疗降低了 53% 的疾病进展风险。
2.针对 EGFR-TKI 治疗后残留病变的治疗策略
在进行全身治疗的同时,对于持续存在的残留病变,可采用局部消融治疗、立体定向放疗(SBRT)或手术治疗,这有助于防止因一线 EGFR TKI 治疗压力而引发耐药性突变。
3.三代 EGFR TKI 治疗进展后的治疗策略
当患者对三代 EGFR TKI 产生耐药性并出现系统性进展时,可采取多种联合治疗策略,如铂类化疗联合或不联合抗血管生成药物、化疗联合 PD-(L) 1 免疫治疗以及抗血管生成治疗。对于特定的获得性耐药机制,如 EGFR C797S 突变或 MET 扩增,目前有多项临床研究正在进行探索。
近年来,在 EGFR 突变晚期非小细胞肺癌(NSCLC)的治疗方面,涌现出了诸多新的治疗方法。但目前,尚未有明确的治疗顺序推荐。确定何种治疗手段能给患者带来最大益处,实则是一项极为复杂的任务。这是因为大多数临床研究主要将无进展生存期(PFS)和客观缓解率(ORR)作为主要研究终点。在评估不同治疗顺序的效果时,很少有研究以第二次无进展生存期(PFS2)或总生存期(OS)为终点。同时,临床研究通常未充分考虑联合治疗策略可能产生的毒性对患者生活质量及后续治疗的影响。
现有临床研究数据表明,EGFR 突变晚期 NSCLC 患者不应被视为单一群体。在确定最佳治疗顺序时,需综合考虑多种临床和生物学因素,包括肿瘤大小、是否存在脑转移、EGFR 突变类型、共突变情况、基线循环肿瘤 DNA(ctDNA)水平以及治疗期间的变化。此外,在治疗过程中,需关注以下三个方面:首先,患者的体力状况(PS)评分,这对于评估患者整体状况及其对预后的影响至关重要;其次,治疗的副作用以及患者的个人偏好,尤其是在一线治疗时;最后,了解患者在一线治疗方案后可能出现的耐药机制,因为不同的治疗选择可能导致不同的耐药途径。
例如,对于携带 21L858R 和 TP53 共突变、存在包括症状性脑转移在内的侵袭性多发转移的年轻患者,奥希替尼联合化疗似乎起效更快,且更有机会实现长期疾病控制,包括颅内疾病控制。相反,对于携带 19del 突变(无共突变)、PS 评分为 2 分且仅有颅外单一转移灶的老年患者,奥希替尼单药治疗更能使此类患者获益。
需要指出的是,不同的一线治疗选择会导致后续治疗方案存在差异,但迄今为止,尚缺乏相关的 OS 数据来证实一种治疗顺序优于另一种治疗顺序。每次在疾病出现进展时,还需进行二次组织或液体活检,以明确靶向治疗的耐药机制,从而为后续治疗提供指导。
总之,EGFR-TKI 的出现为 EGFR 突变晚期 NSCLC 治疗带来了革命性的变化。在当前临床治疗手段日益多样化的背景下,临床实践中应结合每位患者的具体情况,为其 “量身定制” 合适的治疗顺序,实现更加精准的个体化治疗,使患者最大程度地获益。